资讯 | 广西大学发现肝癌治疗新药,揭示肝癌治疗新靶点-pg电子官方
近日,广西大学研究团队在国际权威杂志《cell death discovery》上发表了题为“sophoridine derivative 6j inhibits liver cancer cell proliferation via atf3 mediated ferroptosis”的研究论文,该研究首次报道了槐定衍生物6j在体外和体内具有良好的抗肝癌作用。化合物6j通过促进细胞内fe2 、活性氧(ros)和mda的积累诱导肝癌细胞铁死亡。铁抑素-1抑制铁死亡可减轻6j诱导的fe2 、ros和mda的积累,恢复细胞活力。进一步研究发现,化合物6j可通过内质网应激上调atf3的表达,通过rna干扰下调atf3可减弱6j诱导的铁死亡和细胞增殖抑制。本研究将为铁死亡诱导剂的设计和抗肝癌药物的开发提供新的思路。

研究背景
肝癌是癌症相关死亡的第四大常见原因,每年死亡病例超过83万例。肝细胞癌(hcc)、肝内胆管癌(icc)和hcc-icc混合型是肝癌的主要类型。目前肝癌的治疗主要包括手术治疗、放化疗、靶向治疗和免疫治疗。手术治疗是早期肝癌患者的最佳治疗策略。然而,大多数患者被诊断为晚期,失去了手术的最佳机会。全身放疗毒副作用较大,而传统化疗药物(5-氟尿嘧啶、顺铂、阿霉素、吉西他滨)临床效果较差。虽然靶向治疗药物已经取得了一定的临床疗效,但目前只有索拉非尼和乐伐替尼作为一线靶向药物上市治疗晚期肝癌患者,且患者容易出现耐药。免疫疗法已经成为一种很有前途的治疗方法。然而,肝癌患者对免疫治疗的总体应答率不到30%。尽管肝癌的治疗已经取得了很大的进展,但诸如耐药性、可供患者选择的药物很少、副作用大等问题仍然是主要的障碍。因此,开发肝癌新药具有重要意义。
铁死亡是一种由铁依赖性脂质过氧化引起的非凋亡性坏死性细胞死亡。内质网(endoplasmic reticulum, er)作为细胞中膜脂质最丰富的细胞器之一,对铁死亡的启动至关重要。营养缺乏、缺氧、细胞钙稳态失衡、化疗等因素均可诱发内质网应激。大量研究表明,在多种疾病中,内质网应激可促进铁死亡。近年来,铁死亡被报道在肿瘤治疗中发挥重要作用。研究发现,铁死亡可以降低肿瘤细胞对抗肿瘤药物的获得性耐药性。在肿瘤细胞中诱导铁死亡可以增强免疫治疗的效果。在肿瘤治疗中,铁死亡还介导了放疗和免疫治疗之间的协同作用。这些结果表明,铁死亡是一个潜在的靶点,药物atf3可能是肿瘤治疗的一种选择。
在前期研究中,研究人员合成了一系列槐甾醇的衍生物,其中衍生物6j在不影响top i活性的情况下,对肝癌、肺癌和鼻咽癌表现出最强的细胞毒性作用,表明6j可能有一种替代的抗癌机制。
研究过程及发现
细胞死亡与肿瘤的发生发展密切相关。在肿瘤细胞中,抑制凋亡的蛋白(如mcl-1和bcl-2)被选择性上调,而促进凋亡的分子(如p53和bax)被突变或下调,导致肿瘤细胞对凋亡不敏感。从形态学和机制上看,铁死亡不同于细胞凋亡,细胞凋亡的特征是细胞内fe2 、ros和脂质过氧化的积累。肿瘤细胞对铁死亡更为敏感,诱导癌细胞铁死亡是一种很有前途的癌症治疗策略。多种临床已使用或具有较强临床转化潜力的药物均可诱导铁死亡,如索拉非尼、拉帕替尼、扎西他滨、纳拉替尼等。因此,开发铁死亡诱导剂具有重要的研究意义和临床价值。
在本研究中,研究人员报道了一种槐定衍生化合物6j在肝癌细胞中作为铁死亡诱导剂。与母体化合物槐定的ic50值大于5 mm相比,6j具有显著的抗肝癌作用,ic50值小于10 μm。在机制上,6j通过诱导铁死亡发挥其抗增殖作用,而铁死亡对槐定诱导的增殖抑制没有作用。本研究为设计基于槐定结构的铁死亡诱导剂提供了思路。
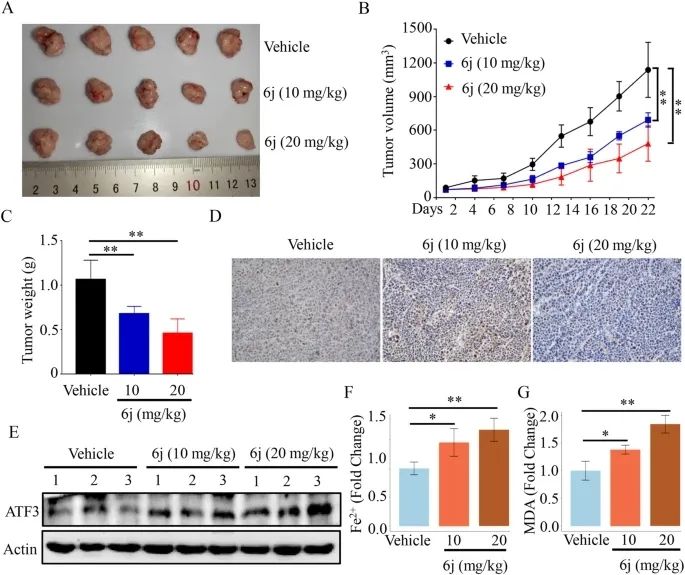
化合物6j抑制肿瘤生长
既往研究表明,atf3可以抑制肝癌的发生和发展。同时,atf3被报道为药物性铁死亡的关键介质。研究结果提示atf3是肝癌的潜在靶点和铁死亡的关键介质。基于atf3开发铁死亡诱导剂具有良好的应用前景。在本研究中,研究人员发现槐定衍生物6j可以通过内质网应激上调肝癌细胞atf3的表达。敲除atf3可消除6j诱导的铁死亡和增殖抑制。数据进一步揭示了atf3在铁死亡中的作用,并证明atf3是诱导铁死亡药物设计的一个有希望的靶点。
研究意义
综上所述,研究人员报道了槐定碱衍生物6j,它通过atf3介导的铁死亡表现出强大的抗肝癌作用。研究结果表明,通过6j上调atf3可能是治疗肝癌的潜在有效方法。(来源:)
参考资料:
https://www.nature.com/articles/s41420-023-01597-6#