前沿 | 华中农大彭楠团队开发首个来自古菌的tnpb微型基因编辑工具-pg电子官方
基于crispr-cas9或cas12a的基因编辑工具已经得到广泛应用,成为推动生命科学、现代农业、医学和合成生物学等领域快速发展的重要动力。但是,基因编辑工具的应用仍面临巨大挑战。例如, 由于cas9及cas12a核酸酶系统分子量巨大(通常大于1000个氨基酸),限制了递送效率等。更重要的是,由于缺乏crispr-cas9及cas12a的底层知识产权,基于该系统的基因编辑技术成为我国基因编辑应用的“卡脖子”技术难题。
2023年11月11日,华中农业大学彭楠教授课题组在 cell discovery 期刊发表了题为:reprogramming an rna-guided archaeal tnpb endonuclease for genome editing 的研究论文。
该研究开发了全球首个来自古菌域的rna引导的微型编程性核酸酶系统——sistnpb1,可在多种不同生长温度的微生物中实现高效基因编辑,有望为现代生物育种提供自主知识产权的高效基因编辑工具。

目前,所有cas9及cas12a等编程性核酸酶均来自细菌。而古菌编码的编程酶没有得到有效发掘。
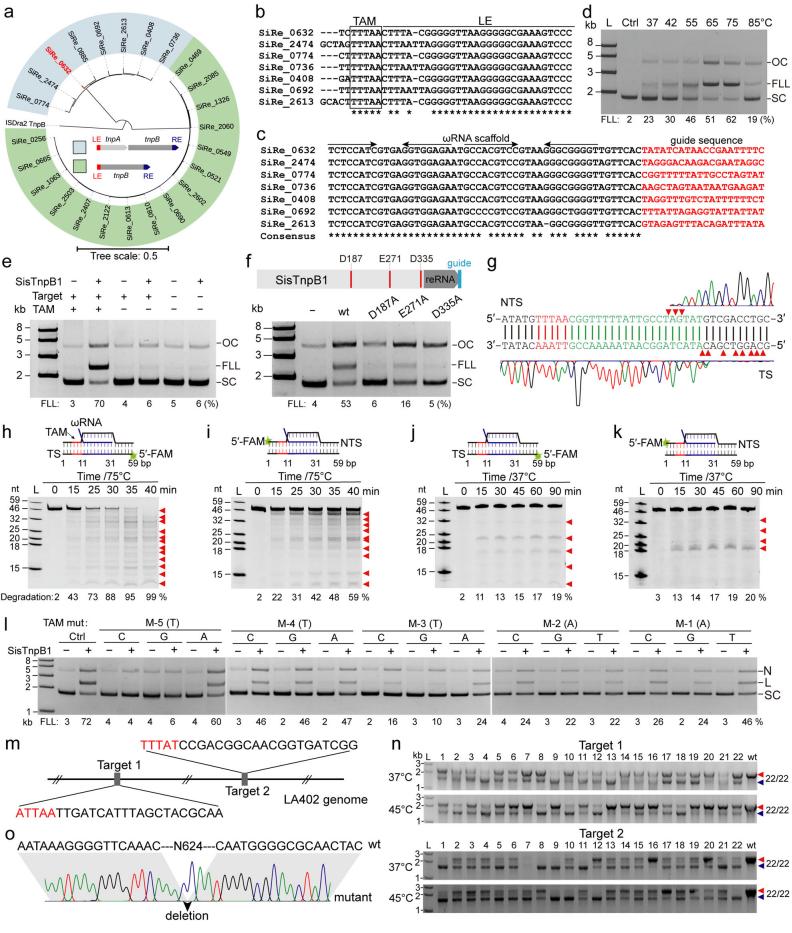
在这项研究中,彭楠教授课题组从古菌sulfolobus islandicus rey15a中鉴定了23个is200/605家族编码的tnpb编程酶性核酸酶。该酶具有分子量小(40 kda)、与已报道的rna引导的编程性核酸酶同源性低(<30%)等特点,具有开发成自主知识产权基因编辑工具的巨大潜力。
研究团队通过生信分析,准确预测了引导rna(grna)结构和识别靶标dna的序列以及引发tnpb切割的tam(transposon-associated motif)序列。通过纯化其中一个典型的tnpb(命名为sistnpb1)及其结合的grna核糖核蛋白复合物(rnp)进行体外核酸切割实验,发现sistnpb1在较广的温度活性范围内(37-85℃)均具有活性,其中最适温度在65-75℃之间。
此外,sistnpb1具有tam依赖的切割特异性并且是mg2 和mn2 依赖特性。通过测序分析切割产物,发现其与cas12家族蛋白具有相似的dna交错切割特点,突变sistnpb1的ruvc域的任意保守氨基酸均严重降低其切割活性。通过对靶标dna碱基突变分析,表明靶标序列最关键的“种子”序列位于 1到 10的位置,且靶标序列 1核苷酸突变强烈抑制sistnpb1 rnp的切割活性。此外,sistnpb1只需一个不保守的tam序列(5 '-wnhnn-3 ')即可用于引发靶标dna的切割。
研究团队在细菌体内验证了sistnpb1的靶向切割活性。通过设计靶向质粒等外源遗传元件的grna,sistnpb1系统可以在细菌体内37℃条件下实现特异性切割并消除这些遗传元件。最终,该团队将sistnpb1系统开发成为全球首个来自古菌的微型基因编辑工具,在乳酸片球菌(37和45℃)及冰岛硫化叶菌(75℃)中实现了精确的基因编辑,编辑效率>90%。研究团队申请了中国发明专利和pct专利各一项。
鉴定全球首个来自古菌的微型编程酶性核酸酶系统sistnpb1并开发为高效的基因编辑工具
华中农业大学生科院徐颖博士研究生为该论文第一作者,刘涛博士后为论文第二作者,彭楠教授为论文通讯作者。(来源:)
论文链接:
https://www.nature.com/articles/s41421-023-00615-2