前沿 | 柴人杰/钟桂生团队开发aav基因疗法,治疗遗传性耳聋-pg电子官方
世界卫生组织(who)发布的最新听力报告指出,目前全球超过4.3亿人患有听力损失,到2025年听障人士可能增加至7亿。基因突变是导致先天性耳聋的主要病因之一,超过150个基因的突变与人类非综合征性耳聋的发生发展有关。目前,临床上治疗耳聋的方法主要局限于助听器和人工耳蜗,还没有针对人类遗传性听力损失的生物治疗方法。
东南大学柴人杰教授团队长期致力于理解听力相关骨架蛋白结构与功能的关系。前期,柴人杰教授团队与上海科技大学钟桂生团队利用超分辨率显微技术发现了血影蛋白spectrin(sci adv. 2019)以及肌动蛋白f-actin(cell discov. 2019)在听力毛细胞表皮板中的规律性超微结构,并揭示了该结构对听力发育的关键作用。
毛细胞表面的纤毛能感知声波震动,其内的骨架蛋白是否也有规律性结构,以及这些骨架结构对于听力功能和耳聋基因治疗的意义尚未有深入研究。内耳毛细胞(hair cells,hcs)是听觉上皮组织中的声音感受器。毛细胞通过其表面的静纤毛感知并转导声音信号。静纤毛主要包含平行的肌动蛋白纤维束,其在肌动蛋白相关蛋白的作用下交联排列。静纤毛直径在与毛细胞胞体的连接处迅速变窄,该区域称为锥形区域(taper region),为静纤毛挺立提供刚性支持。tprn因其定位于锥形区域而得名。tprn由耳聋基因tprn编码,tprn的突变导致小鼠和人类遗传性听力损失,但潜在分子机制尚未被阐明。
近日,东南大学附属中大医院柴人杰教授团队联合上海科技大学钟桂生教授团,在 molecular therapy 期刊发表了题为:critical role of tprn rings in the stereocilia for hearing 的研究论文。
该研究发现遗传性耳聋致病蛋白tprn在静纤毛根部的锥形区域形成环状结构,环状tprn的维持与tprn的表达量相关,其表达过多或过少均导致环状结构的破坏,从而导致听力损伤。为获得适量的tprn重新表达,研究团队利用锤头状核酶(hammerhead ribozymes,hhr)结合广谱启动子去控制aav递送的tprn表达量,实现了体内tprn的适量表达,恢复了tprn敲除鼠毛细胞里的tprn环状结构,最终恢复了耳聋模型小鼠的听力。
该研究详细解析了tprn的致聋机制,并为临床应用aav介导的基因治疗预防和治疗tprn突变引起的常染色体隐性遗传性耳聋79型(dfnb79)提供了一种潜在治疗方法。

研究团队使用受激发射损耗显微技术(stimulated emission depletion microscopy,sted),发现tprn在静纤毛根部的锥形区域形成环状结构,该结构在与之存在相互作用的clic5和ptprq的作用下保持稳定,三者形成的复合物可能排列成同心圆环结构。进一步,研究人员通过肽段竞争性结合、tprn过表达和tprn敲除试验破坏tprn环状结构会导致严重的静纤毛退化和听力损失。
首先,通过破坏tprn和clic5的相互作用,引发环状tprn解体,会造成静纤毛的缺失或融合,小鼠听力受损严重。随后,研究人员发现tprn具有剂量效应。tprn过表达的毛细胞中,tprn表达定位改变,环状tprn也被解体,小鼠的静纤毛出现更为严重的损伤;而在tprn敲除小鼠中,小鼠的静纤毛也出现较为严重的损伤。因此,研究人员认为tprn的表达量对于环状结构和听力的维持至关重要。
研究团队在利用靶向毛细胞的腺相关病毒(aav)进行的tprn基因治疗研究设计中,使用了改良的i型锤头状核酶(hammerhead ribozymes,hhr),以达到恢复听力功能的目的。锤头状核酶(hhr)是一种能够催化rna剪切反应的功能核酸大分子,可在特定的位置对底物rna进行剪切,降低转录活性。
该研究结果表明hhr的变体n107v1递送的外源tprn可以在tprn缺陷小鼠中再现环状tprn结构并有效恢复受损的听力。
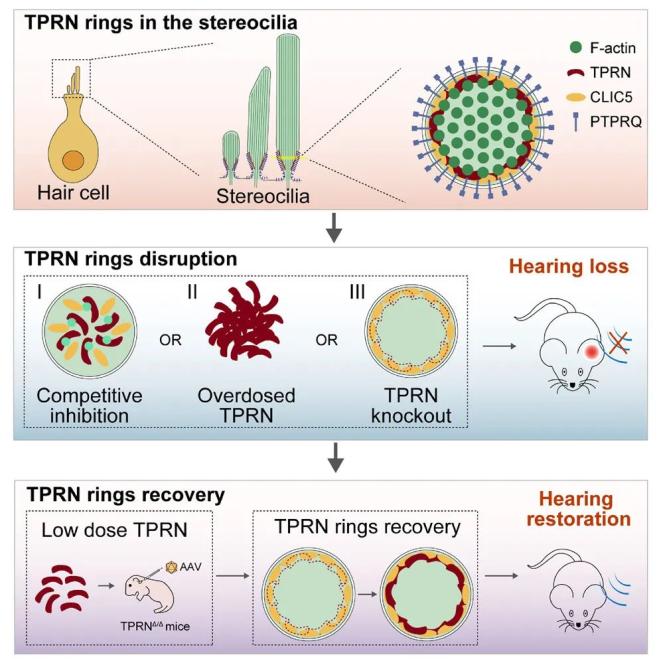
综上所述,该研究确定了tprn在维持耳蜗结构和听力功能中的作用:使用超分辨率成像方法表征了tprn-clic5-ptprq在静纤毛中的组织和模式,并发现环状tprn的空间组织在听力功能中以剂量依赖的模式起关键作用。tprn环的破坏会导致听力受损,反之aav介导的环状tprn恢复可以部分挽救听力受损。该研究为aav介导的基因治疗提供了新的角度,提示某些遗传性疾病的治疗需要特别关注治疗剂量以规避毒性效应。
东南大学柴人杰教授、上海科技大学钟桂生研究员为论文共同通讯作者。东南大学至善博士后齐洁玉、副研究员谈方志、博士后张李燕为论文共同第一作者。(来源:本文转载自公众号“生物世界”)
论文链接:https://doi.org/10.1016/j.ymthe.2023.11.011